01. (UNICAMP) Como um químico descreve a cerveja? “Um líquido amarelo, homogêneo enquanto a garrafa está fechada, e uma mistura heterogênea quando a garrafa é aberta.
Constitui-se de mais de 8.000 substâncias, entre elas o dióxido de carbono, o etanol e a água. Apresenta um pH entre 4,0 e 4,5, e possui um teor de etanol em torno de 4,5 % (v/v).”
Sob a perspectiva do químico, a cerveja
a) apresenta uma única fase enquanto a garrafa está fechada, tem um caráter ligeiramente básico e contém cerca de 45 gramas de álcool etílico por litro do produto.
b) apresenta duas fases logo após a garrafa ser aberta, tem um caráter ácido e contém cerca de 45 ml de álcool etílico por litro de produto.
c) apresenta uma única fase logo após a garrafa ser aberta, tem um caráter ligeiramente ácido e contém cerca de 45 gramas de álcool etílico por litro de produto.
d) apresenta duas fases quando a garrafa está fechada, tem um caráter ligeiramente básico e contém 45 ml de álcool etílico por 100 ml de produto.
Constitui-se de mais de 8.000 substâncias, entre elas o dióxido de carbono, o etanol e a água. Apresenta um pH entre 4,0 e 4,5, e possui um teor de etanol em torno de 4,5 % (v/v).”
Sob a perspectiva do químico, a cerveja
a) apresenta uma única fase enquanto a garrafa está fechada, tem um caráter ligeiramente básico e contém cerca de 45 gramas de álcool etílico por litro do produto.
b) apresenta duas fases logo após a garrafa ser aberta, tem um caráter ácido e contém cerca de 45 ml de álcool etílico por litro de produto.
c) apresenta uma única fase logo após a garrafa ser aberta, tem um caráter ligeiramente ácido e contém cerca de 45 gramas de álcool etílico por litro de produto.
d) apresenta duas fases quando a garrafa está fechada, tem um caráter ligeiramente básico e contém 45 ml de álcool etílico por 100 ml de produto.
02. (UFPB) No mundo atual, são produzidas milhões de toneladas de compostos nitrogenados, entre os quais os fertilizantes são os mais importantes pelo papel que desempenham na produção de alimentos. Esses adubos agrícolas nitrogenados são fabricados a partir da amônia, que é produzida industrialmente através da síntese de Haber-Bosch, descrita pela seguinte equação:
N2(g) + 3 H2(g) ⇄ NH3(g) ∆H = -113 kJ/mol
Considerando a equação e a condição de equilíbrio do sistema, é correto afirmar que o rendimento da produção de amônia:
a) diminui com a remoção de NH3.
b) aumenta com a elevação da temperatura.
c) aumenta com o aumento da concentração de H2.
d) permanece inalterado com a diminuição da concentração de N2.
e) permanece inalterado com a redução do volume do reator.
03. (ENEM) Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
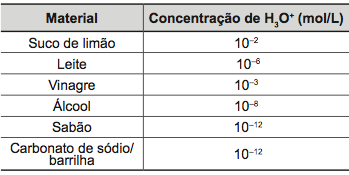
a) Álcool ou sabão.
b) Suco de limão ou álcool.
c) Suco de limão ou vinagre.
d) Suco de limão, leite ou sabão.
e) Sabão ou carbonato de sódio/barrilha.
04. (ENEM) Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfectada. As equações das reações químicas envolvidas são:
Cℓ2 (g) + 2 H2O (ℓ) ⇔ HCℓO (aq) + H3O+ (aq) + Cℓ− (aq)
HCℓO(aq)+H2O(ℓ) ⇔ H3O+ (aq)+CℓO− (aq) pKa =−logKa =7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
a) 0
b) 5
c) 7
d) 9
e) 14
05. (ENEM) Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia de que seja uma protease gástrica, que age no estômago digerindo proteínas. Sabendo que a digestão no estômago é ácida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
a) cubo de batata em solução com pH = 9.
b) pedaço de carne em solução com pH = 5.
c) clara de ovo cozida em solução com pH = 9.
d) porção de macarrão em solução com pH = 5.
e) bolinha de manteiga em solução com pH = 9.
06. (ENEM) Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0 x 10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa:
CH3COOH, Na2SO4 , CH3OH, K2CO3 e NH4Cℓ.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
a) CH3COOH
b) Na2SO4
c) CH3OH
d) K2CO3
e) NH4Cℓ
07. (ENEM) Hipoxia ou mal das alturas consiste na diminuição de oxigênio (O2) no sangue arterial do organismo. Por essa razão, muitos atletas apresentam mal-estar (dores de cabeça, tontura, falta de ar etc.) ao praticarem atividade física em altitudes elevadas. Nessas condições, ocorrerá uma diminuição na concentração de hemoglobina oxigenada (HbO2) em equilíbrio no sangue, conforme a relação:
Hb(aq) + O2(aq) ⇄ HbO2(aq)
Mal da montanha. Disponível em: www.feng.pucrs.br. Acesso em: 11 fev. 2015 (adaptado).
A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
a) elevação da pressão arterial.
b) aumento da temperatura corporal.
c) redução da temperatura do ambiente.
d) queda da pressão parcial de oxigênio.
e) diminuição da quantidade de hemácias.
08. (ENEM) Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.
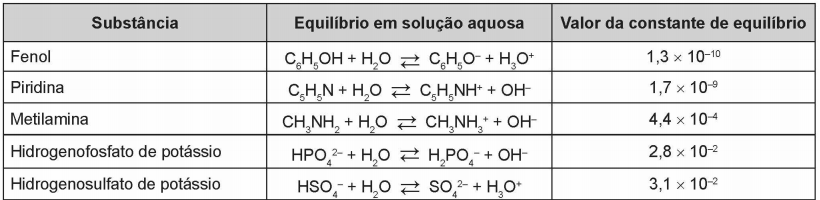
Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
a) fenol.
b) piridina.
c) metilamina.
d) hidrogenofosfato de potássio.
e) hidrogenosulfato de potássio.
09. (FUVEST) A uma determinada temperatura, as substâncias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o equilíbrio entre as três substâncias foi estudado, em recipientes fechados, partindo-se de uma mistura equimolar de H2 e I2 (experimento A) ou somente de HI (experimento B).
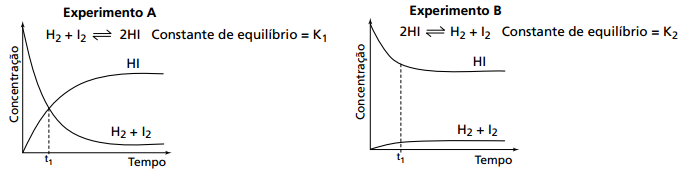
a) no experimento A, ocorre diminuição da pressão total no interior do recipiente, até que o equilíbrio seja atingido.
b) no experimento B, as concentrações das substâncias (HI, H2 e I2) são iguais no instante t1.
c) no experimento A, a velocidade de formação de HI aumenta com o tempo.
d) no experimento B, a quantidade de matéria (em mols) de HI aumenta até que o equilíbrio seja atingido.
e) no experimento A, o valor da constante de equilíbrio (K1) é maior do que 1.
10. (FUVEST) O fitoplâncton consiste em um conjunto de organismos microscópicos encontrados em certos ambientes aquáticos. O desenvolvimento desses organismos requer luz e CO2, para o processo de fotossíntese, e requer também nutrientes contendo os elementos nitrogênio e fósforo.
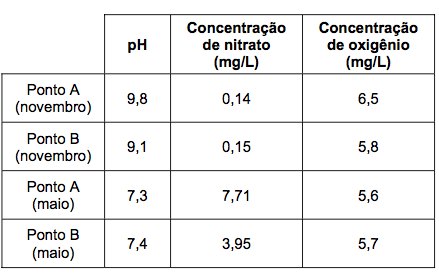
Com base nas informações da tabela e em seus próprios conhecimentos sobre o processo de fotossíntese, um pesquisador registrou três conclusões:
I. Nessas amostras, existe uma forte correlação entre as concentrações de nitrato e de oxigênio dissolvidos na água.
II. As amostras de água coletadas em novembro devem ter menos CO2 dissolvido do que aquelas coletadas em maio.
III. Se as coletas tivessem sido feitas à noite, o pH das quatro amostras de água seria mais baixo do que o observado.
É correto o que o pesquisador concluiu em
a) I,apenas.
b) III,apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
11. (FUVEST) Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta pH 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que a solução resultante apresente pH 8 é
a) 2
b) 6
c) 10
d) 14
e) 18
12. (FUVEST) Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
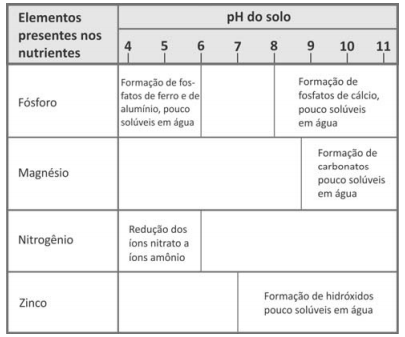
a) 4 e 6.
b) 4 e 8.
c) 6 e 7.
d) 6 e 11.
e) 8,5 e 11.
13. (PUC-SP) A amônia é um produto industrial de grande relevância, sendo matéria-prima para a produção de fertilizantes. A amônia é obtida em larga escala pelo processo Haber em que são empregados nitrogênio e hidrogênio sob alta pressão a 450°C. A equação que representa o processo é
N2(g) + 3 H2(g) ⇆ 2 NH3(g)
sendo que o Kc dessa reação a 25°C é de 3,5 x 108, enquanto que o Kc medido a 450°C é de 0,16. Sobre a reação de síntese da amônia foram feitas as seguintes afirmações.I. Trata-se de uma reação de oxidorredução em que o gás hidrogênio é o agente redutor.
II. Trata-se de um processo endotérmico e por isso é realizado em alta temperatura.
III. Alterar a pressão dos reagentes modifica o valor de Kc.
IV. A 450°C a velocidade de formação de amônia seria bem maior do que a 25°C, considerando-se que as pressões parciais dos reagentes no início da reação fossem as mesmas em ambas as temperaturas.
Estão corretas apenas as afirmações
a) I e II.
b) II e IV.
c) III e IV.
d) I e III.
e) I e IV.
14. (UFRGS) A constante de equilíbrio da reação de conversão abaixo tem o valor de 0,5.
Glicose 6-Fosfato ↔ Frutose 6-Fosfato
Se essa reação parte de Glicose 6-Fosfato pura, o grau de conversão deste reagente em produto, quando a reação atinge o equilíbrio, é de aproximadamente
a) 10%
b) 25%
c) 33%
d) 50%
e) 66%
15. (FATEC) Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma:
a) xícara de café bem quente;
b) garrafa de água mineral gasosa fechada;
c) chama uniforme de bico de Bunsen;
d) porção de água fervendo em temperatura constante;
e) tigela contendo feijão cozido.
16. (UNESP) O estireno, matéria-prima indispensável para a produção do poliestireno, é obtido industrialmente pela desidrogenação catalítica do etilbenzeno, que se dá por meio do seguinte equilíbrio químico:
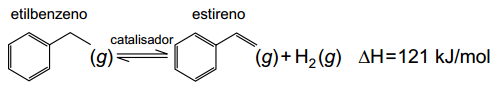
a) a entalpia da reação aumenta com o emprego do catalisador.
b) a entalpia da reação diminui com o emprego do catalisador.
c) o aumento de temperatura favorece a formação de estireno.
d) o aumento de pressão não interfere na formação de estireno.
e) o aumento de temperatura não interfere na formação de estireno.
17. (UNESP) Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
As lacunas do texto devem ser preenchidas, respectiva-mente, por:
a) não se altera — aumenta — aumenta
b) não se altera — não se altera — não se altera
c) não se altera — aumenta — não se altera
d) aumenta — diminui — aumenta
e) diminui — aumenta — aumenta
18. (FAMERP) Considere o equilíbrio químico representado por
C (s) + CO2 (g) ⇄ 2CO (g) ; ∆H = +88 kJ / mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da _______, com a diminuição da ______ e não se altera pela adição de _______.As lacunas do texto são, correta e respectivamente, preenchidas por:
a) temperatura – pressão – catalisador.
b) temperatura – pressão – CO2 (g).
c) pressão – temperatura – catalisador.
d) pressão – temperatura – CO2 (g).
e) pressão – temperatura – C (s).
19. (IME) Considere a reação, em equilíbrio, de produção do alvejante gasoso dióxido de cloro, que ocorre em um sistema reacional:
Cl2(g) + 2NaClO2(s) ⇄ 2ClO2(g) + 2NaCl(s)
Nessa situação, assinale a alternativa correta.
a) A adição de mais clorito de sódio ao sistema desloca o equilíbrio da reação, de forma a produzir mais alvejante gasoso.
b) A razão entre as constantes de equilíbrio KP/KC é igual a 0,0820568⋅T, em que T é a temperatura do sistema reacional, medida em kelvin.
c) A retirada parcial de cloreto de sódio do sistema desloca o equilíbrio da reação, de forma a produzir menos alvejante gasoso.
d) A constante de equilíbrio KP é igual à constante de equilíbrio KC.
e) Para duas diferentes temperaturas do sistema reacional, desde que elevadas e compatíveis com a manutenção do equilíbrio, o valor numérico da constante de equilíbrio KP é o mesmo, mantendo inalterada a produção de alvejante gasoso.
20. (UFAC) Uma reação atinge o equilíbrio químico:
I. Quando não há mais reagentes, somente produtos.
II. Quando as concentrações dos reagentes são iguais às concentrações dos produtos.
III. Quando a velocidade da reação direta é igual à velocidade da reação inversa.
IV. Quando as concentrações de reagentes e produtos tornam-se constantes.
V. Quando não existe mais reação química.
As afirmações corretas são:
a) I e II
b) II e III
c) III e IV
d) IV e V
e) III e V
➤ GABARITO
01
|
02
|
03
|
04
|
05
|
06
|
07
|
08
|
09
|
10
|
B
| C | C | B | B | D | D | D | E | D |
11
|
12
|
13
|
14
|
15
|
16
| 17 | 18 | 19 | 20 |
E
| C | E | C | B | C | C | A | B | C |

Nenhum comentário:
Postar um comentário