1. (UCDB-MT) As propriedades coligativas das soluções dependem:
a) Da pressão máxima de vapor do líquido.
b) Da natureza das partículas dispersas na solução.
c) Da natureza do solvente, somente.
d) Do número de partículas dispersas na solução.
e) Da temperatura de ebulição do líquido.
2. (VUNESP/96 – Conhec. Gerais) Comparando-se os pontos de congelação de três soluções aquosas diluídas de KNO3, MgSO4 e Cr(NO3)3, de mesma concentração em mol/L, verifica-se que:
a) as três soluções têm o mesmo ponto de congelação.
b) os pontos de congelação decrescem na seguinte ordem:
KNO3 < MgSO4 < Cr(NO3)3.
c) a solução de Cr(NO3)3 tem ponto de congelação mais baixo que as soluções dos outros dois sais.
d) o ponto de congelação de cada solução depende de seu volume.
e) as três soluções têm pontos de congelação maiores que o da água.
3. (FCMSC-SP) Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular não volátil.
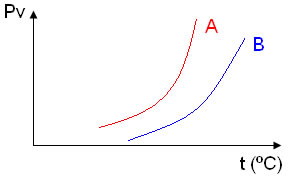
A seu respeito podemos afirmar:
a) A curva A representa a solução.
b) A curva A representa o solvente.
c) A curva B representa o solvente.
d) A solução apresenta pressão máxima de vapor maior que o solvente.
e) Ambas as curvas, numa mesma temperatura, apresentam mesma pressão máxima de vapor.
4. (PUCC) Qual das soluções abaixo apresenta maior grau de dissociação iônica?
a) CaCl2 com fator Vant’Hoff igual a 2,5
b) FeCl3 com fator Vant’Hoff igual a 3
c) NaCl com fator Vant’Hoff igual a 1,9
d) Na2CO3 com fator Vant’Hoff igual a 2,6
e) N. D. A.
5. (OSEC) A pressão do vapor de um líquido puro molecular depende:
a) Apenas da estrutura de suas moléculas.
b) Apenas da massa específica do líquido.
c) Apenas da temperatura do líquido.
d) Da estrutura de suas moléculas e da temperatura do líquido.
e) Da estrutura de suas moléculas e do volume do vapor.
6. (MACK) Um solvente puro tem temperatura de ebulição (te) e temperatura de solidificação (ts). Adicionando-se soluto não volátil ao solvente, as temperaturas de ebulição e solidificação para a solução serão (t’e) e (t’s), respectivamente. É correto afirmar que:
a) te < t’e e ts < t’s
b) te < t’e e ts > t’s
c) te > t’s e ts > t’s
d) te = t’s e ts = t’s
e) te > t’e e ts < t’s
7. (RIO PRETO – JUNDIAÍ) Qual das propriedades abaixo é comum a todos os líquidos?
a) Transformarem-se em gases acima de 100°C.
b) Solidificarem-se abaixo de 0°C.
c) Formarem, entre si, misturas heterogêneas.
d) Ferverem à temperatura constante, independentemente de serem puros ou não.
e) Apresentarem pressões de vapor diferentes a temperaturas diferentes.
8. (UnB) A temperatura da ebulição de água é 100°C, quando a PMV da água, nessa temperatura, é de:
a) 1 atm
b) 1 torr
c) 1 mmHg
d) todas estão corretas
e) N.D.A.
9. (Fuvest-SP) Sob mesma pressão, comparando-se as temperaturas de ebulição e do congelamento de uma solução aquosa de açúcar com as correspondentes para a água pura, tem-se:
a) Valores maiores para as temperaturas referentes à solução.
b) Valores menores para as temperaturas referentes à solução.
c) Maior temperatura de ebulição e menor temperatura de congelamento para a solução.
d) Menor temperatura de ebulição e maior temperatura de congelamento para a solução.
e) A mesma temperatura de ebulição e diferentes temperaturas de congelamento para a solução e a água.
10. Se deixarmos um ovo cru imerso em uma solução de vinagre por dois dias, observaremos que a casca do ovo desaparecerá completamente e a membrana semipermeável que envolve a clara e a gema ficará à vista. Além disso, o volume do ovo aumentará, isto é, ele inchará e subirá para a superfície. Qual propriedade coligativa está relacionada com esse fenômeno?
a) Tonoscopia.
b) Ebulioscopia.
c) Crioscopia.
d) Osmose.
11. (UFPE) Por que a adição de certos aditivos na água dos radiadores de carros evita que ocorra o superaquecimento da mesma e também o seu congelamento, quando comparada com a da água pura?
a) Porque a água mais o aditivo formam uma solução que apresenta pontos de ebulição e de fusão maiores que os da água pura.
b) Porque a solução formada (água + aditivo) apresenta pressão de vapor maior que a água pura, o que causa um aumento no ponto de ebulição e de fusão.
c) Porque o aditivo reage com a superfície metálica do radiador, que passa então a absorver energia mais eficientemente, diminuindo, portanto, os pontos de ebulição e de fusão quando comparados com a água pura.
d) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento do ponto de ebulição e uma diminuição do ponto de fusão.
e) Porque o aditivo diminui a capacidade calorífica da água, causando uma diminuição do ponto de fusão e de ebulição.
12. (PUC-PR) A adição de 150 g de sacarose a um litro de água pura fará com que:
a) sua pressão de vapor diminua.
b) passe a conduzir corrente elétrica.
c) sua pressão de vapor aumente.
d) seu ponto de ebulição diminua.
e) seu ponto de congelamento aumente.
13. (VUNESP) A crioscopia é uma técnica utilizada para determinar a massa molar de um soluto através da diminuição da temperatura de solidificação de um líquido, provocada pela adição de um soluto não volátil. Por exemplo, a temperatura de solidificação da água pura é 0°C (pressão de 1 atm), mas ao se resfriar uma solução aquosa 10% de cloreto de sódio, a solidificação ocorrerá a –2°C. A adição de soluto não volátil a um líquido provoca
A) nenhuma alteração na pressão de vapor desse líquido.
B) o aumento da pressão de vapor desse líquido.
C) o aumento da temperatura de solidificação desse líquido.
D) a diminuição da temperatura de ebulição desse líquido.
E) a diminuição da pressão de vapor desse líquido.
14. (ITA) Considere as seguintes afirmações relativas aos sistemas descritos abaixo, sob pressão de 1atm:
I. A pressão de vapor de uma solução aquosa de glicose 0,1mol/L é menor do que a pressão de vapor de uma solução de cloreto de sódio 0,1mol/L a 25ºC.
II. A pressão de vapor do n-pentano é maior do que a pressão de vapor do n-hexano a 25ºC.
III. A pressão de vapor de substâncias puras como: acetona, éter etílico, etanol e água, todas em ebulição, tem o mesmo valor.
IV. Quanto maior for a temperatura, maior será a pressão de vapor de uma substância.
V. Quanto maior for o volume de um líquido, maior será a sua pressão de vapor.
Destas afirmações, estão CORRETAS:
A) apenas I, II, III e IV.
B) apenas I, II e V.
C) apenas I, IV e V.
D) apenas II, III e IV.
E) apenas III, IV e V.
15. (Vunesp) Comparando duas panelas, simultaneamente sobre dois queimadores iguais de um
mesmo fogão, observa-se que a pressão dos gases sobre a água fervente na panela de pressão fechada é maior que aquela sobre a água fervente numa panela aberta. Nessa situação, e se elas contêm exatamente as mesmas quantidades de todos os ingredientes, podemos afirmar que, comparando com o que ocorre na panela aberta, o tempo de cozimento na panela de pressão fechada será
A) menor, pois a temperatura de ebulição será menor.
B) menor, pois a temperatura de ebulição será maior.
C) menor, pois a temperatura de ebulição não varia com a pressão.
D) igual, pois a temperatura de ebulição independe da pressão.
E) maior, pois a pressão será maior.
16. ) (ITA) Dois frascos abertos, um contendo água pura líquida (frasco A) e o outro contendo o mesmo volume de uma solução aquosa concentrada em sacarose (frasco B), são colocados em um recipiente que, a seguir, é devidamente fechado. É CORRETO afirmar, então, que, decorrido um longo período de tempo,
A) os volumes dos líquidos nos frascos A e B não apresentam alterações visíveis.
B) o volume do líquido no frasco A aumenta, enquanto que o do frasco B diminui.
C) o volume do líquido no frasco A diminui, enquanto que o do frasco B aumenta.
D) o volume do líquido no frasco A permanece o mesmo, enquanto que o do frasco B diminui.
E) o volume do líquido no frasco A diminui, enquanto que o do frasco B permanece o mesmo.
17. (UFG) Ao preparar uma sopa, um cozinheiro colocou mais sal do que o necessário. Para reduzir a
quantidade de sal no caldo, ele acrescentou batatas descascadas. Após algum tempo, as batatas foram
removidas e a sopa voltou a ter um gosto agradável. O fenômeno, que levou à redução da quantidade de sal no caldo, foi
a) a osmose.
b) a difusão.
c) a variação de pH.
d) o aumento da pressão de vapor.
e) a adsorção.
18. (UFMG) Um balão de vidro, que contém água, é aquecido até que essa entre em ebulição.
Quando isso ocorre,
• desliga-se o aquecimento e a água pára de ferver;
• fecha-se, imediatamente, o balão; e, em seguida,
• molha-se o balão com água fria; então,
• a água, no interior do balão, volta a ferver por alguns segundos.
Assim sendo, é CORRETO afirmar que, imediatamente após o balão ter sido molhado, no interior dele,
a) a pressão de vapor da água aumenta.
b) a pressão permanece constante.
c) a temperatura da água aumenta.
d) a temperatura de ebulição da água diminui.
19. (UFMG) quanto às condições de cozimento de uma mesma quantidade de certo alimento. Ambas estavam ao nível do mar e à mesma temperatura. Foram submetidas à mesma fonte de aquecimento e continham a mesma quantidade de água. Observou-se, então, que
• a água, na panela aberta, entrou em ebulição em menos tempo que na panela fechada;
• o cozimento do alimento foi mais rápido na panela fechada que na panela aberta.
Considerando-se essas observações, é INCORRETO afirmar que:
A) a panela fechada requer mais tempo para atingir a
pressão atmosférica em seu interior.
B) a pressão de vapor da água em ebulição na panela
fechada é maior que a pressão atmosférica.
C) a temperatura de ebulição da água na panela fechada é
maior que 100ºC.
D) o cozimento na panela fechada se passa em temperatura
mais elevada que na panela aberta.
20. (FATEC) Duas amostras de naftalina, uma de 20,0g (amostra A) e outra de 40,0g (amostra B), foram colocadas em tubos de ensaio separados, para serem submetidas à fusão. Ambas as amostras foram aquecidas por uma mesma fonte de calor. No decorrer do aquecimento de cada uma delas, as temperaturas foram anotadas de 30 em 30 segundos .
Um estudante, considerando tal procedimento, fez as seguintes previsões :
I. A fusão da amostra A deve ocorrer a temperatura mais baixa do que a da amostra B.
II. A temperatura de fusão da amostra B deve ser o dobro da temperatura de fusão da amostra A.
III. A amostra A alcançará a temperatura de fusão num tempo menor que a amostra B.
IV. Ambas as amostras devem entrar em fusão à mesma temperatura.
É correto o que se afirma apenas em:
a) I.
b) II.
c) III.
d) II e III.
e) III e IV
21. (ITA) Na pressão de 1atm, a temperatura de sublimação do CO2 é igual a 195K. Na pressão de 67atm, a temperatura de ebulição é igual a 298K. Assinale a opção que contém a afirmação CORRETA sobre as propriedades do CO2.
A) A pressão do ponto triplo está acima de 1atm.
B) A temperatura do ponto triplo está acima de 298K.
C) A uma temperatura acima de 298K e na pressão de 67atm, tem-se que o estado mais estável do CO2 é o líquido.
D) Na temperatura de 195K e pressões menores do que 1atm, tem-se que o estado mais estável do CO2 é o sólido.
E) Na temperatura de 298K e pressões maiores do que 67atm, tem-se que o estado mais estável do CO2 é o gasoso.
22. (Mack) Ao nível do mar, uma solução aquosa de cloreto de sódio 0,1M:
a) tem temperatura de ebulição igual à da água pura.
b) tem ponto de congelamento superior ao da água pura.
c) tem o mesmo número de partículas do que uma solução 0,1M de cloreto de alumínio.
d) tem temperatura de ebulição maior do que a da água pura.
e) não conduz corrente elétrica.
23. (Mack) O valor do ponto de ebulição determinado experimentalmente numa amostra de uma certa substância mostrou-se maior do que o valor encontrado em tabelas.
Essa diferença pode ser atribuída ao fato de que, no experimento, usou-se:
A) um combustível de alto poder calorífico.
B) uma quantidade de substância muito grande.
C) uma quantidade de substância muito pequena.
D) uma substância composta.
E) uma substância contendo impurezas.
24. (Vunesp) Uma das formas de se conseguir cicatrizar feridas, segundo a crença popular, é a colocação de açúcar ou pó de café sobre elas. A propriedade coligativa que melhor explica a retirada de líquido, pelo procedimento descrito, favorecendo a cicatrização, é estudada pela:
A) osmometria.
B) crioscopia.
C) endoscopia.
D) tonoscopia.
E) ebuliometria
25. (Vunesp) Considerando-se 100mL de cada solução e dissociação completa das substâncias iônicas, apresenta maior pressão osmótica a solução aquosa de concentração
A) 0,010 mol/L de uma proteína não dissociada.
B) 0,500 mol/L de frutose.
C) 0,050 mol/L de cloreto de potássio.
D) 0,025 mol/L de nitrato férrico.
E) 0,100 mol/L de cloreto de cálcio.
26. ) (UFU) As substâncias que ocorrem na natureza encontram-se normalmente misturadas com outras substâncias formando misturas homogêneas ou heterogêneas. As misturas homogêneas, ao contrário das heterogêneas, podem ser confundidas, na aparência, com substâncias puras. Uma forma de diferenciar as misturas homogêneas de substâncias puras È determinar as propriedades físicas do sistema em questão como ponto de fusão (PF), ponto de ebulição (PE), densidade e condutividade elétrica. Considerando esse fato, as seguintes afirmativas em relação à água do mar estão corretas, EXCETO:
A) a densidade da água do mar é maior que a densidade da água pura.
B) a água do mar tem pressão de vapor superior à da água pura.
C) a água do mar contém compostos iônicos e moleculares dissolvidos.
D) a água do mar congela numa temperatura inferior à da água pura.
27. (UFMG) Dois tubos de ensaio contém volumes iguais de líquidos. O tubo 1 contém água destilada e o tubo 2, água com sal de cozinha completamente dissolvido. Ao se aquecerem simultaneamente esses tubos, observa-se que a água do tubo 1 entra em ebulição antes da solução do tubo 2. Considerando-se esse experimento, É CORRETO afirmar que a diferença de comportamento dos dois líquidos se explica porque:
A) a temperatura de ebulição da solução é mais alta, para que o sal também se vaporize.
B) a temperatura de ebulição da solução é mais alta, pois as ligações iônicas do sal, a serem quebradas, são fortes.
C) a água destilada, sendo uma substância simples, entra em ebulição antes da mistura de água com sal.
D) a ·água destilada, sendo uma substância pura, entra em ebulição a uma temperatura mais baixa.
GABARITO
I. A pressão de vapor de uma solução aquosa de glicose 0,1mol/L é menor do que a pressão de vapor de uma solução de cloreto de sódio 0,1mol/L a 25ºC.
II. A pressão de vapor do n-pentano é maior do que a pressão de vapor do n-hexano a 25ºC.
III. A pressão de vapor de substâncias puras como: acetona, éter etílico, etanol e água, todas em ebulição, tem o mesmo valor.
IV. Quanto maior for a temperatura, maior será a pressão de vapor de uma substância.
V. Quanto maior for o volume de um líquido, maior será a sua pressão de vapor.
Destas afirmações, estão CORRETAS:
A) apenas I, II, III e IV.
B) apenas I, II e V.
C) apenas I, IV e V.
D) apenas II, III e IV.
E) apenas III, IV e V.
15. (Vunesp) Comparando duas panelas, simultaneamente sobre dois queimadores iguais de um
mesmo fogão, observa-se que a pressão dos gases sobre a água fervente na panela de pressão fechada é maior que aquela sobre a água fervente numa panela aberta. Nessa situação, e se elas contêm exatamente as mesmas quantidades de todos os ingredientes, podemos afirmar que, comparando com o que ocorre na panela aberta, o tempo de cozimento na panela de pressão fechada será
A) menor, pois a temperatura de ebulição será menor.
B) menor, pois a temperatura de ebulição será maior.
C) menor, pois a temperatura de ebulição não varia com a pressão.
D) igual, pois a temperatura de ebulição independe da pressão.
E) maior, pois a pressão será maior.
16. ) (ITA) Dois frascos abertos, um contendo água pura líquida (frasco A) e o outro contendo o mesmo volume de uma solução aquosa concentrada em sacarose (frasco B), são colocados em um recipiente que, a seguir, é devidamente fechado. É CORRETO afirmar, então, que, decorrido um longo período de tempo,
A) os volumes dos líquidos nos frascos A e B não apresentam alterações visíveis.
B) o volume do líquido no frasco A aumenta, enquanto que o do frasco B diminui.
C) o volume do líquido no frasco A diminui, enquanto que o do frasco B aumenta.
D) o volume do líquido no frasco A permanece o mesmo, enquanto que o do frasco B diminui.
E) o volume do líquido no frasco A diminui, enquanto que o do frasco B permanece o mesmo.
17. (UFG) Ao preparar uma sopa, um cozinheiro colocou mais sal do que o necessário. Para reduzir a
quantidade de sal no caldo, ele acrescentou batatas descascadas. Após algum tempo, as batatas foram
removidas e a sopa voltou a ter um gosto agradável. O fenômeno, que levou à redução da quantidade de sal no caldo, foi
a) a osmose.
b) a difusão.
c) a variação de pH.
d) o aumento da pressão de vapor.
e) a adsorção.
18. (UFMG) Um balão de vidro, que contém água, é aquecido até que essa entre em ebulição.
Quando isso ocorre,
• desliga-se o aquecimento e a água pára de ferver;
• fecha-se, imediatamente, o balão; e, em seguida,
• molha-se o balão com água fria; então,
• a água, no interior do balão, volta a ferver por alguns segundos.
Assim sendo, é CORRETO afirmar que, imediatamente após o balão ter sido molhado, no interior dele,
a) a pressão de vapor da água aumenta.
b) a pressão permanece constante.
c) a temperatura da água aumenta.
d) a temperatura de ebulição da água diminui.
• a água, na panela aberta, entrou em ebulição em menos tempo que na panela fechada;
• o cozimento do alimento foi mais rápido na panela fechada que na panela aberta.
Considerando-se essas observações, é INCORRETO afirmar que:
A) a panela fechada requer mais tempo para atingir a
pressão atmosférica em seu interior.
B) a pressão de vapor da água em ebulição na panela
fechada é maior que a pressão atmosférica.
C) a temperatura de ebulição da água na panela fechada é
maior que 100ºC.
D) o cozimento na panela fechada se passa em temperatura
mais elevada que na panela aberta.
Um estudante, considerando tal procedimento, fez as seguintes previsões :
I. A fusão da amostra A deve ocorrer a temperatura mais baixa do que a da amostra B.
II. A temperatura de fusão da amostra B deve ser o dobro da temperatura de fusão da amostra A.
III. A amostra A alcançará a temperatura de fusão num tempo menor que a amostra B.
IV. Ambas as amostras devem entrar em fusão à mesma temperatura.
É correto o que se afirma apenas em:
a) I.
b) II.
c) III.
d) II e III.
e) III e IV
21. (ITA) Na pressão de 1atm, a temperatura de sublimação do CO2 é igual a 195K. Na pressão de 67atm, a temperatura de ebulição é igual a 298K. Assinale a opção que contém a afirmação CORRETA sobre as propriedades do CO2.
A) A pressão do ponto triplo está acima de 1atm.
B) A temperatura do ponto triplo está acima de 298K.
C) A uma temperatura acima de 298K e na pressão de 67atm, tem-se que o estado mais estável do CO2 é o líquido.
D) Na temperatura de 195K e pressões menores do que 1atm, tem-se que o estado mais estável do CO2 é o sólido.
E) Na temperatura de 298K e pressões maiores do que 67atm, tem-se que o estado mais estável do CO2 é o gasoso.
a) tem temperatura de ebulição igual à da água pura.
b) tem ponto de congelamento superior ao da água pura.
c) tem o mesmo número de partículas do que uma solução 0,1M de cloreto de alumínio.
d) tem temperatura de ebulição maior do que a da água pura.
e) não conduz corrente elétrica.
23. (Mack) O valor do ponto de ebulição determinado experimentalmente numa amostra de uma certa substância mostrou-se maior do que o valor encontrado em tabelas.
Essa diferença pode ser atribuída ao fato de que, no experimento, usou-se:
A) um combustível de alto poder calorífico.
B) uma quantidade de substância muito grande.
C) uma quantidade de substância muito pequena.
D) uma substância composta.
E) uma substância contendo impurezas.
24. (Vunesp) Uma das formas de se conseguir cicatrizar feridas, segundo a crença popular, é a colocação de açúcar ou pó de café sobre elas. A propriedade coligativa que melhor explica a retirada de líquido, pelo procedimento descrito, favorecendo a cicatrização, é estudada pela:
A) osmometria.
B) crioscopia.
C) endoscopia.
D) tonoscopia.
E) ebuliometria
25. (Vunesp) Considerando-se 100mL de cada solução e dissociação completa das substâncias iônicas, apresenta maior pressão osmótica a solução aquosa de concentração
A) 0,010 mol/L de uma proteína não dissociada.
B) 0,500 mol/L de frutose.
C) 0,050 mol/L de cloreto de potássio.
D) 0,025 mol/L de nitrato férrico.
E) 0,100 mol/L de cloreto de cálcio.
26. ) (UFU) As substâncias que ocorrem na natureza encontram-se normalmente misturadas com outras substâncias formando misturas homogêneas ou heterogêneas. As misturas homogêneas, ao contrário das heterogêneas, podem ser confundidas, na aparência, com substâncias puras. Uma forma de diferenciar as misturas homogêneas de substâncias puras È determinar as propriedades físicas do sistema em questão como ponto de fusão (PF), ponto de ebulição (PE), densidade e condutividade elétrica. Considerando esse fato, as seguintes afirmativas em relação à água do mar estão corretas, EXCETO:
A) a densidade da água do mar é maior que a densidade da água pura.
B) a água do mar tem pressão de vapor superior à da água pura.
C) a água do mar contém compostos iônicos e moleculares dissolvidos.
D) a água do mar congela numa temperatura inferior à da água pura.
A) a temperatura de ebulição da solução é mais alta, para que o sal também se vaporize.
B) a temperatura de ebulição da solução é mais alta, pois as ligações iônicas do sal, a serem quebradas, são fortes.
C) a água destilada, sendo uma substância simples, entra em ebulição antes da mistura de água com sal.
D) a ·água destilada, sendo uma substância pura, entra em ebulição a uma temperatura mais baixa.
GABARITO
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
0
|
D
|
C
|
B
|
C
|
D
|
B
|
E
|
A
|
C
|
|
1
|
D
|
D
|
A
|
E
|
D
|
B
|
C
|
B
|
D
|
A
|
2
|
E
|
A
|
D
|
E
|
A
|
B
|
B
|
D
|

Tomara que caia na prova do Jean
ResponderExcluirTomara.... Vá rezando....
Excluircaiu?
ExcluirTomara que caia na prova de Thiago
ResponderExcluirvai rezando
Excluirtomara que caia na prova da bruna
ResponderExcluirtomara que caia na prova da Isilda
ResponderExcluirTomara que caia na prova de Dorei...
ResponderExcluirtomara que caia na prova da edlourdes
ResponderExcluirtomara que caia na prova do dicksson
ResponderExcluirTomara que caia na prova do maiko
ResponderExcluirtomara que caia na prova de wendel
ResponderExcluirtomara que caia na prova de wendel
ResponderExcluirtomara que caia na prova de Wendel
ResponderExcluirProfessor Luiz pegou tudo aqui
ResponderExcluirTomara que caia na prova da Rosangela
ResponderExcluirtomara que caia na prova da Alaine
ResponderExcluirtomara que caia na prova do ze roberto
ResponderExcluirtomara que caia na prova do rodrigo
ResponderExcluirtomara que caia na prova do joão
ResponderExcluir